Pisaliśmy już o prawach fizycznych związanych z wodą, a dziś pora na lekcję chemii. Poznajcie wodę od tej naukowej strony!
Jej właściwości chemiczne wynikają z BUDOWY, dlatego właśnie od niej zaczynamy. Zgodnie z chemicznym wzorem, cząsteczka wody czyli H2O, jest zbudowana z dwóch atomów wodoru oraz jednego atomu tlenu. Żeby łatwiej to sobie wyobrazić, warto wiedzieć, że jej kształt odpowiada trójkątowi: w jednym wierzchołku umiejscowiony jest atom tlenu, a w dwóch pozostałych – atomy wodoru. Wiemy też (dzięki badaniom chemików), że kąt pomiędzy wiązaniami wynosi dokładnie 104,45°.
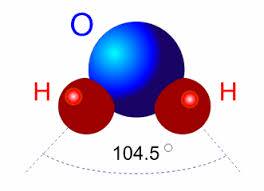
źródło: epodreczniki.open.agh.edu.pl
Tlen i wodór, podobnie jak wszystkie atomy, składają się z jądra i krążących wokół niego elektronów umieszczonych na tzw. powłokach. Tlen na swojej ostatniej powłoce (czyli tzw. powłoce walencyjnej) ma 6 elektronów, a wodór – 1. Jednak w chemii, jak to w życiu – rzadko jest się zadowolonym z tego, co się ma. Dlatego (upraszczając i mówiąc trochę obrazowo) tlen wolałby mieć tych elektronów 8 (czyli tzw. oktet), każdy wodór natomiast dąży do tego, by mieć o 1 elektron więcej, czyli w sumie 2. By to osiągnąć, atomy łączą się tak, że 2 niesparowane elektrony tlenu i po 1 niesparowanym elektronie atomów wodoru tworzą jakby część wspólną, są współdzielone. To idealny układ partnerski, któremu cząsteczka wody zawdzięcza właśnie swój trójkątny kształt. Dzieje się tak dlatego, że choć cząsteczka wody jest obojętna elektrycznie (ma tyle samo ładunków dodatnich, co ujemnych), są one nierównomiernie rozłożone, gdyż wspólne elektrony są przesunięte bliżej „władczego” (czyt. bardziej elektroujemnego) atomu tlenu. O takich cząsteczkach mówi się, że mają budowę polarną i nazywa się je dipolem. Polarność ma wpływ na określone właściwości chemiczne wody. Cząsteczki wody przyciągają się różnoimiennymi biegunami tworząc tzw. wiązanie wodorowe (słabe wiązanie między tlenem jednej cząsteczki wody a wodorem drugiej). Zespół połączonych w ten sposób dwóch lub więcej cząsteczek to asocjaty, a zdolność dipoli do łączenia się nosi miano ASOCJACJI. Przykładem tego, że pojedyncze cząsteczki mogą się łączyć w większe grupy, jest choćby powstawanie płatków śniegu. Dzięki asocjacji tworzą się też struktury białek i wielu innych złożonych substancji o ogromnym znaczeniu biologicznym. Dzięki wiązaniom wodorowym woda ma dużo wyższą temperaturę wrzenia niż inne płyny i pozostaje w stanie ciekłym nawet w rejonach, w których klimat jest bardzo gorący. Co jednak najważniejsze, budowa polarna ma wpływ na to, że woda jest doskonałym rozpuszczalnikiem (więcej o samym procesie rozpuszczania już niebawem na blogu).
Woda jest PRODUKTEM WIELU REAKCJI CHEMICZNYCH. Przykładem może być spalanie wodoru i związków organicznych w obecności tlenu, reakcje zobojętniania, redukcja wodorem związków chemicznych zawierających tlen, a także niektóre reakcje kondensacji. Z drugiej strony jest SUBSTRATEM (PRODUKTEM WYJŚCIOWYM) DO TWORZENIA NOWYCH SUBSTANCJI. Np. w wyniku reakcji wody z tlenkami większości niemetali powstają kwasy, a z tlenkami metali – zasady.
Jak dobrze wiecie, woda jest NIETOKSYCZNA (co nie oznacza, że nie może zawierać zanieczyszczeń), a chemicy zakładają też, że nie ma smaku. My nie do końca się z tym zgadzamy, bo z naszej perspektywy woda jest przecież po prostu PYSZNA (i w ogóle ma same zalety). Niestety niektóre jej właściwości mogą być niekorzystne, np. REAGUJE z metalami, przyczyniając się do ich korozji.
Woda jest najpowszechniej występującą substancją na naszej planecie i niezwykle ważnym związkiem chemicznym. Mamy nadzieję, że dzięki naszej wodnej lekcji zapamiętacie kilka najważniejszych właściwości H2O. Już wkrótce znów widzimy się przy wodnej tablicy blogowej – w zanadrzu mamy dla Was jeszcze sporo informacji 🙂
wsparcie merytoryczne: eszkola-wielkopolska.pl, tygrzyk.norwid24.waw.pl, http://matrix.ur.krakow.pl/, http://joannaroga.pl/, wikipedia.org